펨토바이오메드, 세포내전달 '셀샷' "B세포 신항원 백신개발"

-
- 첨부파일 : 기사 1.jpg (160.1K) - 다운로드
-
1807회 연결
- - 짧은주소 : http://mito.cha.ac.kr/mito/bbs/?t=64
본문
펨토바이오메드 비바이러스성(non-viral) 세포전달 셀샷(CellShot) 기술의 차별성? "항원제시세포 B세포 적용한 신항원 백신개발...파트너십 통해 파이프라인 확장해나갈 것"
‘CAR-T, CAR-NK, 신항원(neoantigen) 암 백신…’ 최근 2~3년간 항암 치료에 새로운 대안을 제시하고 있는 키워드다. 현재 면역항암제 분야에서 가장 주목받고 있는 분야 중 하나로 세포치료제를 꼽을 수 있다. 2017년과 비교해 2019년 면역항암제 후보물질의 글로벌 임상개발 건은 2030개에서 3876개로 91%가 늘었는데, 특히 세포치료제 후보물질은 3배 가까이 늘어 가파른 성장세를 보이고 있다.
그러면 차별성 있는 세포치료제를 만들기 위해 꼭 필요한 기술은 뭘까? 혹은 세포치료제 개발과 상업화 과정에서 부딪히는 어려움은 뭘까? 차세대 CAR-T 치료제 후보물질을 떠올려보면 종양을 인지하는 CAR를 넣기 위해서는 DNA 유전자를 세포내로 전달해야 하며, 동종유래(allogenic) 치료제를 만들기 위해서 DNA, RNA, Cas9, 탈렌(TALEN), 징크핑거큐클레이즈(ZFN) 등 유전자가위를 전달이 필요하다. 나아가 신항원 백신을 만드는 경우 mRNA, 펩타이드 등을 전달해야 한다. 이를 통해 세포의 기능과 특성을 바꾸게 된다. 즉 세포내 전달(intracellular delivery) 기술이 핵심이다.
세포내 전달 기술은 크게 3가지로 나눌 수 있는데 △바이러스벡터(virus vector) △리포좀, 엑소좀 등 비바이러스 전달체(non-viral carrier) △세포막을 열어 물질을 집적 주입하는 전기천공법(electroporation) 등이 있다. 바이러스벡터가 널리 쓰이지만 비용이 비싸고, GMP 수준의 제작이 어려워 세포치료제 제작시 바틀넥이 된다. 길리어드가 119억달러에 인수한 카이트파마(Kite Pharma)는 지난 7월 이러한 문제점을 해결하기 위해 직접 바이러스 생산시설을 짓겠다고 발표하기도 했다. 다른 전달 기술은 품질관리(QC)나 낮은 조직 특이성, 면역원성, 주입시 세포 데미지 등 측면에서 상업화에 한계점이 있다.

그런 면에서 2011년 포스텍에서 시작한 펨토바이오메드(FemtoBiomed)는 세포내 전달체 없이(cargo-free), 일정량의 물질을 여러 세포에 전달할 수 있는 기술을 새로운 대안으로 제시하고 있다. 이상현 펨토바이오메드 대표는 “펨토바이오메드는 바이러스를 이용하지 않고 핵산, 단백질, 저분자화합물 등 일정량, 고농도의 물질을 세포에 직접 주입할 수 있는 셀샷(CellShot™) 기술을 구축했다. 기존의 세포전달 기술과 비교해 표준화가 가능하다는 것과 여러 면역항암제 치료제로 빠르게 확장할 수 있다는 것이 핵심 차별성이다. 독자적인 기술로 올해 미국, 국내 특허등록을 마쳤다”고 소개했다.
펨토바이오메드는 셀샷 기술을 적용해 빠르고, 간편한 B세포 기반의 신항원 백신을 개발하겠다는 목표다. 독특한 점은 B세포를 항원제시세포(antigen presenting cells, APC)로 이용하겠다는 접근법이다. 보통 암 백신은 항원제시세포로 수지상세포(dendritic cell, DC)를 이용하거나 펩타이드, mRNA를 전달하는 방법을 이용한다는 점에서 다르다. 글로벌 업계에서도 B세포 기반 항암백신은 몇 없는데, 국내에서 셀리드(Cellid)가 B세포 기반의 항암백신을 개발하고 있다.
기술의 확장성이 넓은 만큼 제약사, 바이오텍, 병원 등과의 파트너십도 열려있다. 펨토바이오메드는 셀샷 제품을 면역항암제 치료제 개발을 위한 ‘셀샷 온콜로지 플랫폼(CellShot Oncology platform™)’에 적용하는 전환점에 있다. 이를 위한 기반도 마련했다. 펨토바이오메드는 올해 2월 한국투자증권과 위드윈인베스트먼트로부터 시리즈B로 60억원을 투자받았으며, 이어 7월 코넥스에 상장했다.
세포내 전달기술 '셀샷(CellShot)' 차별성
현재 시판된 CAR-T 치료제 노바티스의 킴리아와 길리어드의 예스카르타는 모두 렌티 바이러스(lenti-virus vector) 벡터를 이용한 항암제다. 그러나 앞서 말해듯 바이러스 벡터가 가지는 생산, 비용, 시간 등 측면에서 한계점이 있다. 또한 체내로 들어갈 경우 면역원성을 나타낼 수 있다는 점도 상업화시 중요한 단점으로 꼽힌다. 치료제 분야에서 전기천공법 등 비바이러스 전달기술에 대한 미충족 수요가 있는 이유다.
지난해 미국 UCSF 연구팀은 네이처(Nature)에 전기천공법과 크리스퍼 기술을 합쳐 암질환, 자가면역질환을 타깃하는 세포치료제 연구결과를 발표해 업계에서 주목을 끌었다(doi: 10.1038/s41586-018-0326-5). 연구팀은 전기천공 접근법으로 바이러스 벡터의 한계를 극복할 수 있을 것이라 예상했다. 이 기술로 올해 아스날바이오(ArsenalBio)가 설립됐고, 최근 시리즈A로 8500만달러를 투자받았다. 그밖에 전기천공법 기술이 상용화된 제품으로 핵산물질을 세포에 전달하는 론자의 누클레오펙터(nucleofector)가 있지만 연구 수준에서만 쓰인다.
셀샷은 전기천공법보다 한 걸음 더 나아간 기술이다. 단순하게 말하자면, 세포를 일렬로 줄 세워 하나씩 통과시키면서 물질을 주입하는 기술이다. 또한 핵산 이외에도 펩타이드, 단백질, 고분자 물질 등도 주입할 수 있다. 개념은 간단하지만 고도의 나노기술을 접목한 것이다. 순간적으로 미세전류를 흘러 한 개의 세포에 정교하게 물질을 주입하는 장치, 이러한 과정이 일어나는 세포칩, 일정하고 빠른 속도로 세포를 보내고 감지해 움직임을 제어하는 장치, 자동화 기술 등이 합쳐진 결과물이다. 이 대표가 박사학위 논문에서 연구했던 마이크로/나노유체 기반의 단일세포 분석 기술에서 시작한 아이디어를 고도화해 지난해 자동화된 셀샷 플랫폼(Automated CellShot Platform)을 완성했다.
셀샷 플랫폼에서 눈여겨봐야할 부분은 세포와 주입 물질이 분리돼 있다는 점이다. 세포가 들어가는 채널과 물질을 주입하는 채널이 따로 있어, 중간에 만나는 2D 전달 시스템이다. 각 채널이 따로 있어 세포마다 물질이 전달되는 양에 편차가 적으며, 세포질 혹은 세포핵에 선택적으로 물질을 전달할 수 있다는 장점이 있다. 반면 기존의 전기천공법은 세포와 물질을 섞어놓고 일시적으로 전류를 흘러 물질이 들어가게 한다는 점에서, 1D 전달 시스템으로 이해할 수 있다.
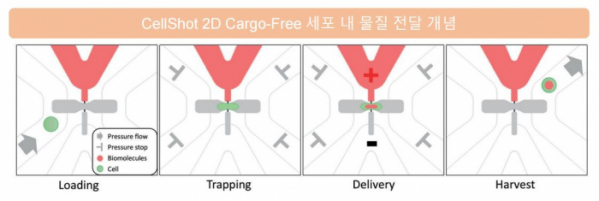
▲셀샷 컨셉, 초록색으로 표시된 것이 세포다. 펨토바이오메드 IR자료.
이 대표는 “세포 표면의 국소적인 부분에 전류가 흐르기 때문에 세포가 받는 데미지를 줄일 수 있다. 이전 연구에 따르면 세포에 물리적이나 전기적인 충격을 가할 경우 세포 기능이 떨어질 수 있다”며 “셀샷 기술은 주입기술과 세포 자동 분리구조, 2D 구조 자체가 특허로 폭넓게 걸려 있어, 경쟁사가 비슷한 개념을 구현하려고 하더라도 특허를 피하가기 어렵다. 또한 셀샷 기술을 치료제에 적용할 때 각 면역세포, 물질마다 특허를 추가할 수 있다”고 부연했다.
셀샷은 한 시간에 1ml 정도의 양을 처리할 수 있다. 세포 수로 처리속도(through-put)를 계산해보면 세포질 전달 당 시간에 100만~1000만개, 세포핵 전달은 시간 당 10만~100만개 수준이다. 세포치료제를 만들 경우 세포질 혹은 세포핵에 전달하냐에 따라 다른 결과물을 얻을 수 있다. 또한 보통 세포 하나에 주입할 수 있는 부피는 펨토리터(femto-litter, 10^(-15))에서 피코리터 수준(pico-litter, 10^(-12))이다. 참고로 보통 암 환자에게 주입하는 CAR-T 세포 개수는 10^6~10^9개 사이다.
펨토바이오메드는 여러 종류의 세포에서 셀샷을 테스트했다. 셀샷 기술을 NK세포주(NK92, NK92MI), 유도만능줄기세포(IPSC), 중간엽줄기세포(MSC), 동물세포 등 다양한 세포에 적용한 결과 세포 안으로 물질(DNA, 플라스미드, 단백질 등)이 효율적으로 전달한 것을 확인했다. 주입 후에도 세포 기능이 유지됐다.
연구팀은 셀샷 시스템으로 형광물질을 단 핵산과 단백질이 줄기세포안으로 들어가는 것을 확인했다. 이 결과는 올해 2월 랩온어칩(Lab on a Chip) 저널에 표지 논문으로 실렸다(doi: 10.1039/C8LC00709H). 또한 체세포에 야마나카 4가지 인자를 플라스미드로 전달했을 때도 약 2%라는 높은 효율로 IPSC가 유도되는 것을 확인한 바 있다. 기존의 플라스미드 효율은 0.0002~0.0005%며, 바이러스벡터도 효율이 1%보다 낮다는 점에서 긍정적인 데이터다.
펨토바이오메드는 여러 종류의 세포 가운데 면역세포를 이용한 항암제 개발을 먼저 진행한다. 올해 셀샷 시스템을 면역세포에 적용한 초기 개념입증 데이터를 낼 계획이다. 펨토바이오메드의 항암제 포토폴리오를 소개하기 앞서 셀샷 기술의 적용 가능성을 보여주는 스퀴즈 바이오텍(SQZ Biotech)의 예를 먼저 살펴보자.
기술이전 모델 'SQZ 바이오텍', 로슈와 빅딜 가능했던 이유?
펨토바이오메드와 비슷한 기술과 전략을 가진 회사로 SQZ 바이오텍이 있다. SQZ 바이오텍은 2013년 MIT 클라브스 젠슨(Klavs Jensen)과 밥 랭거(Bob Langer) 연구팀에 있던 개발자인 아몬 샤레이(Armon Sharei)가 기술을 스핀오프(spin-off)하면서 설립한 회사다. SQZ 바이오텍은 2015년 로슈와 5억달러 규모의 공동연구 개발 협약을 맺었고, 이어 지난해 단기개발 마일스톤 1억2500만달러를 포함해 총 13억달러 규모로 파트너십을 확장했다. 또한 SQZ 바이오텍은 같은 해 시리즈C로 7200만달러를 투자받았다.
SQZ 바이오텍의 기술은 전기천공법과 셀샷 기술의 중간 형태다. 멀티 체널의 1D 세포전달 시스템으로 SQZ 플랫폼(SQZ Platform)으로 부른다. 기술의 차별성은 세포가 미세유체(microfluidic)에 따라 기다란 통로를 지나가다 좁은 통로를 지나는데, 이때 물리적인 압력이 가하면 세포 막이 흐트러지면서 일시적으로 열리게 된다. 이름 그대로 세포를 짓누르는(cell squeezing) 방법이다. 다음으로, 이 상태에서 전기천공법과 같이 전류를 흘러 버퍼(buffer)에 있는 물질이 세포 안으로 들어가는 것이다. SQZ 플랫폼은 기존 기술과 비교해 물질 전달속도가 100배 빠르며, 독성도 적었다. SQZ 바이오텍은 해당 플랫폼을 적용해 항암제와 자가면역질환 세포 치료제를 개발한다.
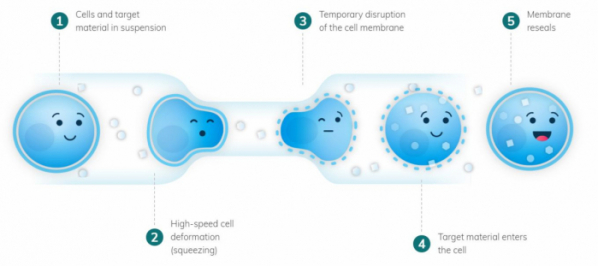
▲SQZ 플랫폼의 컨셉, 회사 홈페이지 자료.
그러면 로슈가 가능성을 엿본 부분은 뭘까? 로슈는 SQZ 플랫폼 기술을 파트너링 케이스로 ‘암과 싸우는 면역세포를 활성화하는 새로운 세포 엔지니어링’이라고 홈페이지에 소개했다(링크). 로슈는 “지난 몇십년 동안 효율적인 세포내 전달 시스템에 대한 니즈가 계속 있어왔지만 어려움이 있었다. MIT 연구팀은 타깃 단백질을 세포내로 전달해 세포 기능을 바꾸는 기술을 찾았고, 다양한 세포 기반 치료제에 적용될 수 있는 잠재력을 가진다”고 소개했다.
로슈는 SQZ 플랫폼을 차세대 항암백신을 만드는데 이용한다. 항원제시세포로 B세포를 이용하는 방법으로 B세포 안으로 암 항원을 전달해 T세포를 활성화해 항암작용을 하는 컨셉이다(doi: 10.1038/srep10276). 이 대표는 “암 항원이 세포 밖에 있는지 혹은 세포 안에 있는지에 따라 항원이 제시되는 MHC 분자가 다르다”며 “특히 세포질에서 골지체(ER)로 전달된 항원 펩타이드는 MHC I 분자에 제시돼, 세포독성(cytotoxic) CD8+ T세포를 활성화할 수 있다. 세포독성 T세포가 효과가 강력한 만큼 암 항원을 MHC I으로 보내는 일은 매우 까다로운데, 그런 측면에서 로슈가 SQZ 기술이 B세포 안으로 암 항원을 효율적으로 전달할 수 있다는 점을 눈여겨본 것”이라고 설명했다.
로슈와 SQZ 바이오텍은 두 가지 비임상 파이프라인을 개발하고 있다. 첫째는 ‘APC HPV’ 프로그램으로 인유두종바이러스(human papillomavirus, HPV) 양성 전이성 자궁경부암, 두경부암 등 고형암 타깃 자가유래(autologous) 세포치료제를 개발한다. SQZ 바이오텍은 올해 AACR에서 APC HPV 후보물질이 HPV 양성 고형암에서 종양내에서 항원 특이적인 CD8+ T세포를 활성화시키며, 종양성장을 억제했다고 발표했다. 두 번째는 고형암 타깃 APC 프로그램으로 자세한 내용은 공개하지 않았다.
세포내 전달 기술로 SQZ 플랫폼의 장점은 분명하다. 특히 우수한 부분은 세포 처리량으로 1분에 40억개 세포를 처리할 수 있다. 다만 한계점도 있다. 첫째, 세포내로 물질이 들어가는 부분은 확산에 의존하기 때문에 고농도의 물질 전달이 어렵다. 둘째, 연구팀은 분자량이 큰 물질을 전달하기 어려웠다고 설명했다. 셋째, 이 방법으로 MHC clss II에 항원을 로딩해 CD4+ T세포를 활성화하지는 못했다고 설명했다.
이 대표는 “셀샷은 SQZ 기술과 비교해 고농도, 고분자 물질을 전달할 수 있다는 장점이 있다. 일정한 양을 전달할 수 있어 QC 면에서도 차별성을 가진다”며 “또한 경쟁사를 고려했을 때 SQZ는 플랫폼 자체에 대한 지배력은 약하다. 반면 셀샷이 강력한 특허를 갖고 있다”고 덧붙였다.
셀샷 적용 사례? B세포 기반 신항원 치료백신
펨토바이오메드는 B세포를 항원제시세포으로 이용한 신항원(neoantigne) 항암백신을 개발하고 있다. 회사가 B세포 기반의 신항원 백신 프로젝트를 시작한 배경은 뭘까? 현재 암 백신 플랫폼으로 사용하는 것은 수지상세포다. 수지상세포는 전문적인 항원제시세포지만, B세포는 항원제시 기능은 하지만 상대적으로 항원을 섭취하는 효율이 떨어진다. 반면 장점도 있다. 수지상세포는 혈액에 소량만 있고, 보통 단핵구로부터 분화시키는데 증식이 어렵다. B세포는 혈액내 풍부하게 있어 쉽게 얻을 수 있다.
셀샷에 적용했을 때 유용한 점도 있다. B세포는 활성화 형태가 아니면 보통 8~10μm의 직경을 가진 둥근 형태지만, 수지상세포는 형태가 일정하지 않다는 설명이다. 따라서 B세포가 고속 시스템에 적용하기 좋다. 그밖에 수지상세포를 항원제시세포로 주로 이용한 이유 가운데 하나는 보조자극 인자(co-stimulatory molecule)을 많이 분비하기 때문이라는 것. 이에 펨토바이오메드는 B세포가 활성화될 수 있는 선천성 면역을 활성화하는 어쥬반트(adjuvant)인 CPZ, poly-IC, TLR4 활성화 약물 등을 함께 처리한다는 설명이다. 비슷한 예로 셀리드는 B세포 표면에 아데노바이러스 백터로 암 항원과 면역증강제를 같이 전달해 T세포 활성을 높이는 ‘Celivax’ 플랫폼을 개발했다.
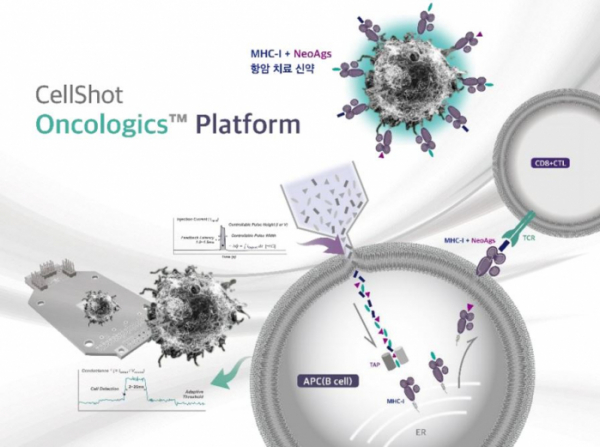
▲셀샷 기술을 적용해 신항원 B세포 치료백신을 만드는 컨셉, 회사IR 자료.
이 대표는 “최근 2~3년 동안 신항원 암 백신을 개발하는 회사들이 대규모 투자유치를 받았지만 임상에서 성공적인 결과를 얻지는 못했다. 보통 대식작용을 통해 항원을 제시, T세포를 활성화하는 방법으로 접근했는데 이 경우 MHC class II로 항원이 주로 제시된다”며 “그런면에서 셀샷 기술은 세포 내로 신항원 펩타이드를 전달해 MHC clss I에 전달해 세포도성 T세포를 활성화할 수 있는 유니크한 전달 체계”라고 강조했다. 또한 예방 백신으로서 MHC class II 분자로 펩타이드를 전달하고 싶은 경우 엔도좀(endosome) 형태로 전달하면 된다는 것.
펨토바이오메드는 면역항암제로서 신항원 암 백신이 가지는 차별성 4가지를 꼽았다. 첫째, 다중타깃을 전달할 수 있다. 암은 기본적으로 이질적인(heterogeneous) 특징을 가진다. 즉 한가지 항원만 공략해서는 암을 없애기 힘들다는 의미다. 둘째, 재발 측면에서다. 암 환자에게서 타깃 치료제는 높은 효능을 내고 있지만, 항원 소실(antigen escape) 등으로 내성을 나타낼 수 있다는 한계점도 있다. 예를 들어 CD19 CAR-T는 혈액암 환자에게서 80~90% 수준의 높은 관해율(remissiion rate)을 보이지만, 현재까지 3분의 1이 넘는 환자가 항원소실로 재발했다고 밝혀졌다. 이에 차세대 다중 타깃 CAR-T가 개발되고 있다. 셋째, 온타깃(on-target) 부작용 우려를 줄일 수 있다. 신항원은 암세포의 유전자 변이에 따라 원래 몸에 없던 항원이 만들어진 것이다. 따라서 기존 타깃 치료제는 암 항원에 발현이 높아진 항원을 타깃한다는 점에서 정상 조직에 암 항원이 발현하면서 나타나는 부작용 우려를 덜 수 있다. 마지막으로 환자 종양 특이적인, 맞춤형 항암제를 제작할 수 있다.
이 대표는 “이제까지 신항원 백신이 임상에서 낮은 효능을 냈던 이유 중 하나는 전달체계가 없어서라고 생각하다. 환자마다 타깃 사이트에 전달하는 암 항원의 용량, 암 이질성, 환자의 면역활성화 정도 등 변수가 많다는 점도 개발을 어렵게 했다. 대부분 회사들은 인공지능(AI) 기술을 통해 면원성이 높은 신항원을 발굴하는데 집중했다”며 “반면 펨토바이오메드는 신항원 펩타이드를 빠르고, 효율적으로 전달하는 기술을 갖고 있다. 이에 환자에 적합한 신항원을 발굴하는 기술을 가진 병원이나 바이오텍과 협력해 적절한 항원을 발굴하겠다는 목표”라고 설명했다.
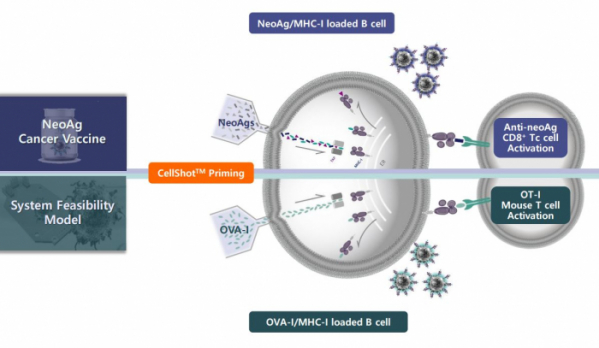
펨토바이오메드는 올해말 OVA-I/MHC-I 시스템에서 셀샷 기술을 적용한 B세포가 실제 항원특이적인 T세포를 활성화하는지, 신제닉 종양 쥐모델에서 항암활성을 나타내는지 등을 테스트할 예정이다. 이 대표는 “SQZ 바이오텍은 OVA 시스템에서 얻은 결과를 바탕으로 로슈와 파트너십을 확장할 수 있었다. 펨토바이오메드도 병원, 바이오텍과 협력을 통해 내년 초기 개념입증 데이터를 얻어 기술이전 딜을 기대하고 있다”고 밝혔다.
이 대표는 향후 계획과 관련, “각 항암 프로젝트마다 적절한 전달 시스템(ONCO-Lab)을 구축하겠다는 목표다. CAR-T, CAR-NK 등을 포함한 면역항암제뿐만 아니라 자가면역질환, 줄기세포 치료제로도 적용 가능하다. 앞으로 파트너십을 통해 확장해나갈 계획”이라고 강조했다.









댓글목록 0