AACR 2018, 성큼 다가온 '암연구 방향&변화 4가지’

-
3842회 연결
- - 짧은주소 : http://mito.cha.ac.kr/mito/bbs/?t=3d
본문
[김태형 테라젠이텍스 CSO 인터뷰]
1. PCA(Pre-Cancer Atlas) 본격 시작 2. 면역항암제, 전암ㆍ초기단계 적용 ‘예방(Prevention)’ 너머 'Protection' 3. 암 정밀진단 기술의 진보 4. 新바이오마커 등장

▲2018 AACR에 참석한 김태형 테라젠이텍스 최고전략책임자(CSO)
"올해 미국암학회(AACR)은 기초연구부터 후기임상 연구결과까지 발표해 암 연구의 트랜드 변화를 다양하게 엿볼 수 있었다. 첫째, TCGA(The Cancer Genome Atlas) 프로젝트는 올해로 완전 종결되고 PCA(Pre-Cancer Atlas)가 본격 시작됐다. PCA는 전암단계의 유전체 데이터를 모아 조기진단을 가능케하는 미국국립암연구소(NCI)가 펀딩해서 진행하는 프로젝트다. 암 발생 이전부터 말기암 단계까지 암이 진행되는 모든 과정에서 일어나는 모든 유전체 변화를 추적조사할 수 있다. 둘째, 면역항암제도 초기 및 전암단계에서부터 치료에 적용해 완치를 목표로 하자는 분위기도 있었다. 따라서 ‘예방(Prevention)’ 개념을 넘어선 'Protection' 용어의 등장으로 조기 암치료 전략이 제시됐다. 셋째, 암 정밀진단 기술은 급속도로 진보하고 있다. 오해 구글 인공지능(AI) 팀이 기조강연에서 첫 연자로 발표한 것도 큰 화제였다. 마지막으로 동반진단의 새로운 바이오마커를 통한 치료전략도 소개됐다.“
김태형 테라젠이텍스 최고전략책임자(CSO)는 최근 기자와 만나 '2018 미국암학회(AACR)' 참관후기를 들려주며 향후 암 연구 방향에 대해 소개했다. 그는 AACR은 본래 기초, 중개연구를 주로 다루지만 올해는 키트루다, 옵디보 등의 임상3상 결과까지 발표되면서 기초연구부터 임상개발 파이프라인에 걸친 암 연구 트랜드를 한눈에 포착할 수 있었다고 전했다. 국내에서는 한미약품, 유한양행(오스코텍), 일동제약, 제넥신(네오이뮨테크), 신라젠, 녹십자 목암연구소, 유틸렉스 등 25개 기업이 AACR에 참가해 항암제 후보물질에 대한 연구결과를 발표했다.
1. 'Pre-Cancer Atlas(PCA)'의 서막
첫째, 'PCA(Pre-Cancer Atlas)'가 본격 시작됐다. 암이 발생하기 이전 단계인 전암(pre-cancer) 상태에서 일어나는 유전체 데이터를 모으는 프로젝트다. 김 CSO는 “지금까지는 말기암 환자를 대상으로 수많은 치료제들이 개발됐지만 암을 완치하는데는 한계가 있었다. 효능 좋은 치료제일지라도 몇 개월 후엔 암이 재발하기 때문이다. 그 한계를 인정하면서 몇몇 연구진을 중심으로 암 초기단계에 진단과 치료를 접목하는 시도들이 보였다”며 “작년 보겔슈타인이 AACR학회에서 말한대로 향후 암 치료 접근법은 ‘조기진단‘과 ’예방‘으로 가야한다. 이를 위해서는 전암 데이터가 필요한데, PCA 프로젝트를 통해 실행할 수 있을 것이다”고 말했다. 전암 아틀라스(PCA)를 통해 전암세포에서 암 세포로 진행되는 과정을 잘 이해함으로써 조기진단을 통한 조기 암치료 전략으로 옮겨질 것이라는 설명이다.
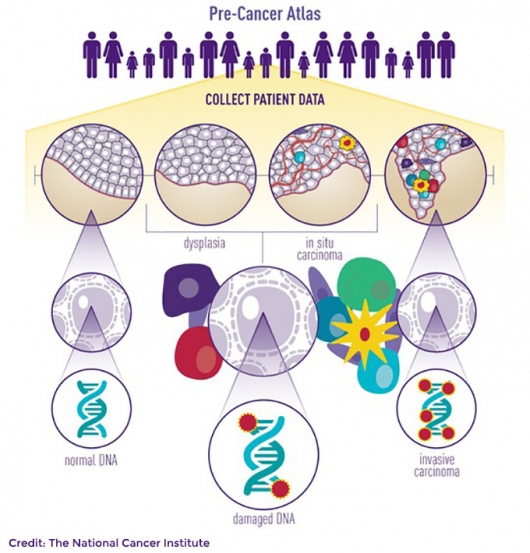
▲전암 아틀라스(Pre-Cancer Atlas) 프로젝트
김 CSO는 전암 아틀라스(PCA)의 연구 케이스를 소개했다. 보스턴 의과대학 연구팀의 편평세포폐암(SqCC)의 전암세포 유전체 특성을 분석한 연구다. 그는 “암은 DNA에 돌연변이가 생겨 발생한다. 정상세포도 분열할 때 돌연변이가 생기는데 암으로 발전되는 그 변화를 알아내야 조기치료가 가능하다”며 “연구팀은 내시경과 CT를 통해 선별된 고위험 흡연자를 대상으로 전암단계부터 지속적으로 샘플을 모았다. 189일이 지나자 암으로 변하는 징조를 보이는 염색체 변이가 발견됐다”고 설명했다. 전암단계에서부터 지속적인 모니터링을 통해 암이 진행되는 찰나의 순간이 포착된 것이다. 3q 증식, 3p 손실, TP53, NOTCH1, CDKN2A 유전자 돌연변이 등 이었다.
그러나 아직 해결해야할 난관도 많다. 의미있는 연구를 수행하기 위해서는 일단 많은 양의 전암 데이터를 모아야 한다. 암이 진행되는 변화과정을 추적하기 위해 FFPE(포르말린 고정 파라핀 조직 단편) 검체도 필요하다. 그는 “아직까지 병원에서 암으로 진단받기 전 상태인 전암샘플을 구하기가 너무 어렵다. 1~3기 초기단계의 환자 데이터도 구하기 어려운 상황이다”며 “암은 진행속도가 빠르기 때문에 한 달 주기로 지속적으로 샘플을 얻고 분석해야한다. 그래서 챌린지(challenge)하다”고 전암연구의 어려움에 대해 설명했다.
그는 이어 “PCA는 기존 TCGA 프로젝트보다 비용도 많이 든다. 펀드규모를 보면 최소 5배가 더 들어갈 듯 하다. 액체생검을 통한 조기진단 개발에 나선 그레일(Grail) 만 봐도 지난해 1조원이라는 대규모 펀딩을 받은 후 홍콩시장에 상장을 통해 1조원 이상의 추가펀딩을 추진하고 있다”고 덧붙였다. TCGA(The Cancer Genome Atlas)는 약 1조 원을 투자해 1만1000명의 암환자에서 33개 암 유전체 데이터(2.5페타바이트(PB)를 생산해 연구진에게 제공한 프로젝트다.
효과적인 조기진단 연구의 방향성도 제시했다. 김 CSO는 “비용이 많이 들기 때문에 현실적으로 효과를 낼 수 있는 암종부터 연구를 진행하는 것이 좋다. 외부환경 노출에 의한 영향을 받으며 physiological 증상 측정이 가능하고, 조직생검이 쉬운 암종부터 우선적으로 연구하는 것으로 방향성이 정해진 것 같다”고 조언했다. 예를 들어, 폐암, 두경부암, 피부암, 유방암, 췌장암, 방광암, 대장암 등이 해당된다. 암 조기진단의 접근법으로 ‘필드효과(Field Effect)'가 제시된 것이다.
2. 암 조기치료 'Prevention' 너머 ‘Protection"으로
두번째 변화로는 조기치료를 꼽았다. 김 CSO는 “조기진단처럼 면역항암제도 초기에 치료할 수 있는 약을 개발해 암 환자를 완치시키자는 분위기다. 현재 각광받고 있는 면역항암제도 2~3년 후에는 끝내 재발되기 마련이다”며 “이제는 심장병, 당뇨병처럼 암도 미리 ‘예방(prevention)'하자고 말할 때가 된 것 같다. 면역예방(Immunoprevention)이 새로운 프론티어다”라고 강조했다. 면역치료제의 사용시기를 말기암 환자에서가 아니라 전암단계에서부터 면역력을 키워서 암을 애초에 막자는 얘기다.
지난해 학회에서 존스홉킨스의 보겔슈타인(Bert Vogelstein) 박사는 조기암진단과 조기암치료에 관한 발표를 하면서 암 치료법의 비전을 제시했다. 그는 “올해는 이와 관련해 연구비 펀드도 생기고 있고, 면역항암제를 조기치료에 사용하자는 주장을 받아들이는 분위기도 보였다”고 전했다.
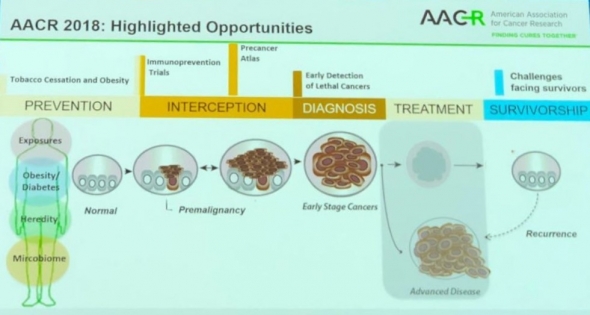
▲2018 AACR, Avrum E. Spira 보스턴 의대 교수 발표자료
항암제에서 중요한 부분은 내성을 잡는 것이다. 정상세포가 분열할 때 30억여개의 DNA에서 100개정도에 변이가 발생하는데, 여기서 repair 유전자, 종양억제유전자 등에 변이가 생기면 암으로 발전하고 더 진행되면 암이 진화(evolution)된다. 김 CSO는 “암은 계속 진화하면서 내성이 생기기 때문에 기존 치료제로는 한계가 있을 수 밖에 없다. 계속 차세대 항암제가 나오는 것도 내성 때문이다. 현재 각광받고 있는 면역항암제도 벌써 내성이 발견되기 시작해 전이, 재발되고 있다”며 “정상세포에서 암으로 가기 전인 ‘Interception' 단계에서 암을 잡는 것이 가장 좋으나 현실적으로 매우 어려운 문제다”고 설명했다.
그는 “결국 ‘예방(Prevention)‘을 너머 ’Protection'으로 가야한다는 주장이 제기됐다. 암은 어쩌다 불운으로 걸리는 것이기 때문에 예방을 할 수 없다. 조기에 막는 방법으로 조치를 취해 'Preotection' 개념으로 암 완치를 목표로 해야한다는 의미다. 이를 위해 전암 아틀라스(PCA)를 통한 조기진단법, 바이오마커 등을 개발하고 전암단계에서 수술 없이도 치료할 수 있도록 조기 항암제를 개발해야한다“고 향후 암치료 방향성에 대해 강조했다.
3. 암 정밀진단을 향한 기술들: NGS, 단일세포 시퀀싱, 액체생검, 인공지능 등
올해 AACR에서 다가온 세번째 변화로 암 정밀진단의 진일보를 위한 다양한 기술의 발전을 꼽았다. 김 CSO는 “NGS, 단일세포 시퀀싱, 액체생검, 인공지능 기술 등이 놀라운 속도로 발전하고 있다. NGS는 이제 루틴해졌다. 암 게놈, 전사체, 후성유전학을 이해하는데 다양하게 사용되고 있다. 임상적으로도 NGS 기반 진단을 통해 암 치료법을 선택하고 예후를 예측하는데 활용되고 있다. 대표적인 예가 IMPACT 패널이다”고 설명했다.
Michael Berger 박사는 지난달 18일 기조강연에서 메모리얼 슬론 캐터링 암센터(Memorial Sloan Kettering Cancer Center, MSK)의 IMPACT 유전자패널의 임상결과를 발표했다. ‘MSK-IMPACT‘는 지난해 11월 FDA로부터 최초로 승인된 암 패널검사다. 환자의 종양조직을 분석해 468개의 엑손(exon) 유전자 돌연변이와 재발시 발생하는 20개의 인트론(intron)을 검사해 효과적인 항암제를 찾는다. 그는 “병원에 오는 전이암 환자 모두 암 유전자 패널 검사에 들어가며, 그중 약 42%가 임상시험에 들어가는 항암제로 치료를 시도하고, 실제로 항암제를 사용한 경우는 17%였다. 암패널 검사로 유전자 돌연변이에 맞는 적합한 경우는 임상시험에 등록된 환자의 12%였다. 보통 치료 가능한 target aberration이 5~10%인 것에 비하면 높은 수치다”고 설명했다.
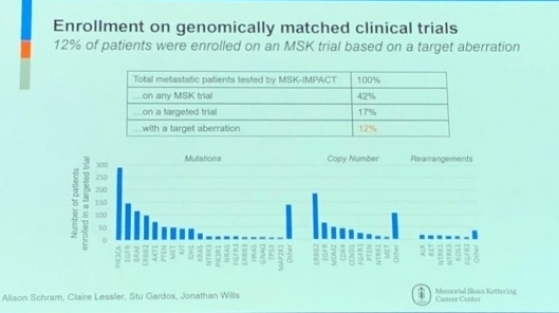
▲2018 AACR, Elaine Mardis Nationwide Children's Hospital 박사 발표자료. 메모리얼 슬론 캐터링 암센터의 'MSK-IMPACT' 임상결과 소개
AACR 이니셔티브인 GENIE(Genomics Evidence Neoplasia Information Exchange) 프로젝트도 함께 소개했다. 그는 “GENIE는 의료기관들의 빅데이터를 모으고, 서로 공유하고, 통합하는 프로젝트다. 현재까지 약 4만건의 데이터를 모았다. 통합된 빅데이터를 기반으로 치료전략을 제시하는 등 의미있는 결과를 도출하는 것이 목표다. 빅데이터가 등장하면서 딥러닝, 인공지능 기술을 활용해서 암의 병용치료 전략 등을 분석하는 연구도 많이 나오고 있다”고 말했다.
단일세포 시퀀싱(Single-cell sequencing) 기술도 빠른 속도로 발전하고 있는 분야다. 암과 종양미세환경을 단일세포 단위에서 연구할 수 있게 된 것이다. 그는 “이번에 싱글셀 시퀀싱을 보다 더 저렴하게 분석할 수 있는 툴이 나왔다. 현재 면역항암제에서 중요한 부분이 차가운 종양(cold tumor)에서 뜨거운 종양(hot tumor)으로 전환시키는 것이다. 싱글셀 시퀀싱 기술은 종양미세환경, 종양이질성 등을 분석하는데 가장 유용한 기술이다. 2000개가 넘는 세포를 개별로 분석해 PD1, CTLA 항체를 처리했을 때 면역세포의 변화를 관찰할 수 있다”며 “지금은 RNA 수준에서 싱글셀을 분석할 수 있는데, 이번에 10x Genomics에서 DNA 수준에서도 단일세포를 분석하는 솔루션을 개발해 발표했다. 더 저렴하게 싱글셀 레벨에서 연구자들이 암의 이질성을 연구하는데 사용할 수 있도록 기술이 빠르게 진보하고 있다”고 강조했다.
그는 “액체생검 연구는 정말 루틴해졌다. 액체생검을 통해 순환종양세포와 암 돌연변이 사이의 상호작용을 밝혀냄으로써 치료 반응성을 비롯한 치료 과정을 모니터링할 수 있게 됐다. 진단과 치료 저항성을 나타내는 기전연구도 활발히 수행되고 있다. 액체생검을 통한 암 조기진단법도 가시화되고 있다”고 말했다. 올해는 그레일(GRAIL)이 혈중종양DNA(circulating tumor DNA, ctDNA) 분석기술에 기반을 둔 액체생검 전향적 대규모 임상시험 2건과 영국 프랜시스 크릭연구소의 찰스스완톤(Chares swanton) 연구팀의 TRACERx 임상결과를 발표해 주목받았다. 자세한 임상결과 내용은 다음 기사에서: [김태형의 게놈이야기]AACR서 만난 3가지 액체생검임상(http://www.biospectator.com/view/news_view.php?varAtcId=5406)
특히 구글 AI팀은 기조강연에서 발표하면서 화제가 됐다. 김 CSO는 “올해 개최된지 110년을 맞은 AACR 학회에서 회사가 기조강연 발표를 한 것은 처음이었다. 이날 구글 팀은 증강현실을 이용한 병리 인공지능 현미경을 공개하면서 병리 인공지능의 가능성에 대해 보여줬다”고 말했다. 구글 팀이 발표한 전이성 유방암의 판독결과, 병리과 의사의 정확도가 0.73인데 반해 인공지능은 0.91였다. 췌장암은 병리과 의사와 인공지능이 0.86으로 동일했다. AUC 값은 유방암과 췌장암에서 각각 0.98, 0.96으로 높은 편이었다.
이에 대해 김 CSO는 “구글팀의 결과 인공지능이 병리과 의사과 비슷하거나 더 나은 수준으로 암을 판독할 수 있었다. 암 유형에 따라 결과가 다르긴 했지만 향후 자동화, 효율화 측면에서 인공지능이 병리 임상의를 도와주는 방향으로 자리 잡을 것이다”고 설명했다.
4. 새로운 동반진단 바이오마커 ‘종양변이부담(TMB)'
올해 AACR은 특히 임상시험 연구결과도 상당부분 발표됐다. 김 CSO는 “특히 종양변이부담(Tumor Mutational Burden, TMB)은 동반진단 바이오마커로 새롭게 부상했다“며 BMS의 임상 3상시험인 CheckMate-227 연구를 예를 들었다. 해당 연구는 종양변이부담(TMB)가 높은 진행성 비소세포폐암 환자를 대상으로 옵디보와 여보이의 병용치료를 진행했다. 중간결과 무진행생존기간(PFS)이 43%로 화학요법의 13%에 비해 우수한 효과를 보였다. 이 결과는 PD-L1 발현여부와 종양의 조직학적 특성(편평, 비편평)과 관계없이 나타났다. 머크의 키트루다에 대항하기 위해 BMS가 PD-L1 바이오마커의 한계를 넘어서는 새로운 바이오마커를 찾은 셈이다. 현재 BMS는 파운데이션메디슨과 함께 종양변이부담을 평가하기 위한 동반진단법 ‘FoundationOne CDx‘의 개발을 진행하고 있다.
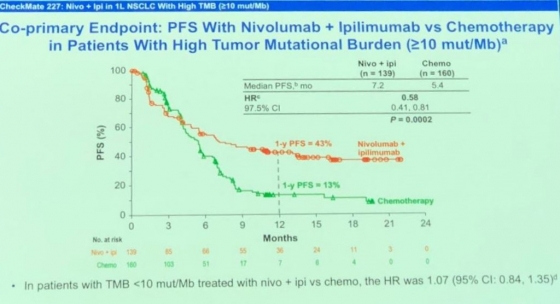
▲2018 AACR 학회에서 Michael A. Caligiuri 시티오브호브 교수 발표자료. BMS의 'CheckMate 227' 임상결과
표적치료제의 반응성 예측을 위한 바이오마커도 있었다. CDK4/6 저해제 ‘이브란스(Ibrance, 성분명 palbociclib)’를 위한 PCCNE1(Cyclin E1)이다. 전이성 유방암 환자에서 PCCNE1 유전자 발현에 따라 팔보디클립의 효과는 강한 연관성을 가진다는 ALOMA 임상3상 연구결과를 발표했다.
김 CSO는 “임상단계 연구측면에서는 올해도 동반진단과 관련한 치료전략이 소개됐다. BMS가 종양변이부담에 대한 바이오마커로 체계적으로 임상을 한 결과 우수한 효과를 보인 것이다. 또한 면역요법 병용치료와 예측 바이오마커를 개발하기 위해 치료제 내성 회피기전에 대한 기초연구 필요성에 대한 논의도 이어졌다. 특히 임상시험에서 OS, PFS, irRECIST 등과 관련된 새로운 종결점(endpoint)이 필요하다는 의견도 제시됐다”고 설명했다.









댓글목록 0