‘세포발전소’ 미토콘드리아 타깃 글로벌 신약개발 현황은?

-
- 첨부파일 : pic.jpg (164.8K) - 다운로드
-
3557회 연결
- - 짧은주소 : http://mito.cha.ac.kr/mito/bbs/?t=54
본문
바이오스펙테이터 조정민 기자
나스닥 상장 'Stealth biotherapeutics' 비롯해 NeuroVive·Khondrion 등 미토콘드리아 기능 조절하는 신약 임상 진행

미토콘드리아는 산소와 영양소를 이용해 세포의 활동 및 생존에 필요한 에너지를 생산하는 세포소기관이다. 우리가 살아가면서 하는 모든 것들은 미토콘드리아가 만들어낸 에너지를 통해 이뤄진다.
바꿔 말하면, 미토콘드리아가 유전이나 손상 등 여러 요인에 의해서 제 기능을 수행하지 못하게 됨으로써 발생하는 질환도 생각 이상으로 다양할 수 있다는 것을 의미한다. 실제로 단순히 에너지 대사 기능의 원인으로 여겨지던 미토콘드리아가 최근에는 다양한 연구를 통해 암과 혈관질환 뿐만 아니라 치매, 파킨슨병 등을 포함하는 퇴행성 신경질환에서도 중요한 원인으로 주목받으면서 새로운 신약 타깃으로 급부상, 실험실 차원을 넘어선 상업화 연구가 활발히 이뤄지고 있다.
이러한 움직임은 해외에서 미리 발빠르게 이뤄지고 있으며 현재 미토콘드리아 타깃 신약의 후기 임상을 진행하고 있는 회사들도 눈에 띄고 있다. 바이오스펙테이터는 그 중에서 최근 나스닥 상장 소식을 알린 Stealth biotherapeutics와 함께 NeuroVive, Khondrion 등 미토콘드리아 신약 개발에 중점을 둔 기업들의 파이프라인을 살펴봤다.
◇ Stealth biotherapeutics : Elamipretide
스텔스 바이오테라퓨틱스(Stealth biotherapeutics)는 미토콘드리아의 기능부전으로 인한 질병들의 치료제를 개발하기 위한 연구를 진행하고 있다. 이들은 미토콘드리아가 제대로 기능을 수행하지 못함으로 인해서 희귀 유전질환과 노화와 관련된 여러가지 질환들이 발생한다고 보고 미토콘드리아 기능회복에 초점을 맞췄다.
미토콘드리아를 살펴보면 매우 높은 밀도로 겹쳐있는 내부 막(inner membrane)이 존재한다. 이를 크리스테(Cristae)라고 부르는데 이 곳에서 5개의 단백질 복합체로 구성된 전자 이동 체인을 통해 ATP가 생성된다. 크리스테에는 구조를 형성하고 ATP 형성을 위한 전자 이동 체인 기능을 최적화하기 위한 카디오리핀(Cardiolipin)이라는 인지질이 존재한다.
미토콘드리아의 기능이 제대로 이뤄지지 않으면 에너지원으로 사용되는 ATP의 생성이 줄어들면서 활성산소(Reactive oxygen species; ROS)의 농도가 증가하게 된다. 정상보다 과도하게 생성된 ROS는 카디오리핀에 손상을 주고, 이로 인해 미토콘드리아의 크리스테 구조가 망가지면서 더 심각한 손상이 이어지게 되는 것이다. 미토콘드리아의 기능이 망가지면 결국 세포는 사멸에 이르게 된다.
스텔스 테라퓨틱스는 미토콘드리아 내부로 침투해 이 카디오리핀과 결합함으로써 미토콘드리아의 기능을 회복시키는 펩타이드 후보물질 ‘Elamipretide’를 개발하고 있다. 회사 측은 전임상과 임상을 통해 Elamipretide가 미토콘드리아 내막의 카디오리핀과 결합해 미토콘드리아 호흡을 증가시키고 전자 이동계 기능과 ATP 생산을 향상시키는 것을 확인했으며 병리적 ROS 형성을 감소시키는 결과를 얻었다고 밝혔다.
스텔스 테라퓨틱스는 원발성 미토콘드리아 근육병(Primary mitochondrial myopathy; PMM), 바스 신드롬(Barth syndrome), 레베르 유전성 시신경병증(Leber’s hereditary optic neuropathy) 등의 질환에 대해 Elamipretide 임상을 진행하고 있다.

▲스텔스 바이오테라퓨틱스의 파이프라인. (출처: 스텔스 바이오테라퓨틱스 홈페이지)
가장 빠르게 진행되고 있는 것은 원발성 미토콘드리아 근육병(PMM) 파이프라인이다. PMM은 미토콘드리아의 기능 이상으로 인해 골격근이 약화되고 운동 불내성이 나타나는 것이 특징인 유전성 희귀질환이다. 이를 치료하기 위해 허가된 약물은 아직까지 존재하지 않는다. Elamipretide는 해당 적응증에 관해 미국 FDA로부터 희귀의약품(Orphan drug designation; ODD)과 신속심사대상(Fast track)으로 지정됐다.
스텔스는 2017년 4분기부터 PMM 환자 200명을 대상으로 Elamipretide의 임상3상(MMPOWER-3)을 수행하고 있다. 16~80세의 환자에게 매일 피하주사 형태의 Elamipretide를 적용하고 대조군과 비교해 약효와 안전성을 평가한다. 1차종결점은 6분간 걸을 수 있는 거리(6-minute walk test) 개선과 PMM 증상 평가 도구를 통해 산정한 점수로 설정됐다.
Elamipretide는 이전에 30명의 환자를 대상으로 진행했던 임상2상(MMPOWER-2)를 통해 효능을 증명한 바 있다. 4주간 Elamipretide를 적용받은 환자들은 6분간 걷는 거리가 대조군 대비 평균 20미터 이상 증가했다. 또한 PMM 증상 평가 도구를 이용해 산정한 총 피로 점수 역시 유의미하게 개선되는 결과를 보였다.
PMM 외에도 유전자 이상으로 인해 카디오리핀이 결핍되면서 심근병증, 근력 저하, 성장 지연 등의 증상이 발생하는 바스 신드롬을 타깃으로 하는 임상2/3상(TAZPOWER)과 중심시야 손실 등이 발생하는 레베르 시신경병증과 관련된 임상2/3상(ReSIGHT), 건성 노인성 황반변성(Dry age-related macular degeneration; dry AMD)에 대한 임상1상(ReCLAIM) 등이 진행되고 있다.
스텔스 테라퓨틱스는 저분자 화합물과 펩타이드에 대한 라이브러리를 구축하고 스크리닝을 통해 미토콘드리아에 효과적으로 작용하는 후보물질을 발굴하고 있다. Elamipretide 후속 후보물질인 SBT-20의 경우 미토콘드리아 기능부전으로 인해 발생하는 퇴행성 뇌질환을 타깃으로 연구를 진행 중이다. 또한 이들은 후보물질을 미토콘드리아 내로 더 확실히 전달하기 위한 ‘Mitochondrial Carrier Technology(MCT)’ 플랫폼 기술을 개발하고 있다.
이렇게 후기 임상 파이프라인을 보유한 스텔스 테라퓨틱스는 지난 2월, 성공적으로 나스닥(NASDAQ)에 상장했다. 2월 27일(현지시각) 기준 스텔스 테라퓨틱스의 시가총액은 4억달러를 기록했다.
◇ NeuroVive: NeuroSTAT
국내에서 영진약품의 물질을 기술이전한 것으로 이름을 알린 스웨덴 기반의 제약기업 뉴로바이브(NeuroVive)는 미토콘드리아의 기능에 이상이 발생하면 결국 세포가 사멸하게 되는 현상에 주목, 미토콘드리아의 기능을 보전하고 또 강화함으로써 세포를 보호하는 신약을 개발한다.
여러가지 질환 가운데서도 이들은 세포가 사멸되고 나서 다시 생성되거나 재생되는 것이 가장 어려운 ‘뇌’라는 장기에 초점을 맞췄다. 현재 보유한 8개의 파이프라인 가운데 가장 빠른 진행을 보이고 있는 물질인 ‘NeuroSTAT’은 외상 후 뇌 손상(Traumatic brain injury; TBI)을 적응증으로 임상2상을 완료했다.
외상 후 뇌 손상은 머리에 충격 등의 외력이 가해지면서 신경세포가 손상돼 나타나는 질환으로 손상의부위나 정도에 따라 차이가 있으나 신체적 운동기능, 인지기능, 정신적인 기능에 문제를 야기한다. 매년 5000만건 이상의 환자가 발생하는 것으로 알려졌다.
외부적 충격이 발생한 이후 손상된 신경세포의 미토콘드리아는 미토콘드리아 투과성 전이 기공(mitochondria permeability transition pore; mPTP)이 활성화된다. mPTP를 통해 세포 내외의 물질들이 이동하게 되는데 특히 미토콘드리아 내로 물의 유입이 증가한다. 팽창이 유발된 미토콘드리아는 에너지 생산 기능이 저하되고 결국 해당 세포의 항상성이 무너지면서 세포는 죽음에 이르게 된다.
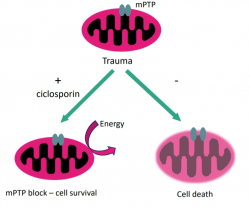
뉴로바이브는 미토콘드리아 투과성 전이 이공의 활성을 차단함으로써 미토콘드리아와 세포의 항상성을 유지하는 기전의 NeuroSTAT(ciclosporin)을 개발하고 있다. NeuroSTAT은 우선적으로 mPTP의 활성을 억제해 미토콘드리아의 손상을 낮추고 신경세포 내 세포골격 파괴도 감소시키는 것으로 확인됐다. 회사 측은 마우스, 양 등을 이용해 수행한 20여건 이상의 동물 전임상 연구를 통해 외상 후 뇌 손상에 대한 NeuroSTAT의 신경보호 효과를 확인했다고 밝혔다.
뉴로바이브는 외상 후 뇌 손상 환자들을 대상으로 진행한 초기 임상에서 NeuroSTAT의 안전성과 약동학을 평가했고, 그 결과 사고 후 8~12시간 이내에 NeuroSTAT을 적용한 환자들에게서 6개월 이후 관찰결과가 용량의존적으로 유의미하게 개선됐고 뇌 내 미세투석 환경(Microdialysis)과 대뇌 혈류 동태(cerebral hemodynamics)에도 긍정적인 변화를 발견했다.
임상2a상(CHIC)은 16명 규모의 외상 후 뇌 손상 환자를 대상으로 진행됐다. 모집 대상자는 뇌손상 환자의 의식사정과 상태 평가를 위해 개발된 글래스고 혼수 척도(Glasgow Coma Scale; GCS) 4~8점을 기록한 심각한 정도의 뇌손상 환자였으며, 모집된 환자들은 각각 저용량군(5mg/kg/day)과 고용량군(10mg/kg/day)으로 나눠져 5일~8일동안 지속적으로 NeuroSTAT을 적용받았다. 투약 후 30일동안 경과를 관찰하면서 환자의 상태 및 중대 부작용 발생 여부를 확인했다.
해당 임상을 통해 NeuroSTAT이 혈관-뇌 장벽(Blood-brain barrier)을 효과적으로 통과해 표적에 제대로 도달하는 것과 심각한 부작용이 발생하지 않는 안전한 약물이라는 것을 증명했다. 또한 MRI 촬영을 진행해 뇌 손상 정도를 측정했을 때 NeuroSTAT을 적용받은 환자의 뇌 손상이 35%가량 감소하는 결과를 얻었으며, 뇌의 에너지 대사와 미토콘드리아 호흡 기능을 개선하고 활성산소(ROS)의 생성을 억제하는 것을 관찰했다.
뉴로바이브는 환자 모집 정원을 60~100명 규모로 확대한 임상2b상을 설계했다. 중등~중증의 외상 후 뇌 손상 환자에서 위약 대비 NeuroSTAT의 효과를 평가하기 위해서다. 이들은 이를 위해 사용할 새로운 바이오 마커를 발굴하는 연구도 진행했다. 미국의 플로리다 대학교 Kevin KW Wang 박사와 함께 진행한 실험에서 뇌 손상 환자의 뇌척수액을 반복적으로 채취해 뇌 세포 손상을 반영하는 GFAP, UCH-1, NF-L 및 Tau 바이오 마커를 측정, 평가했다. 해당 인자들은 성상세포 및 신경세포의 손상에 따라 방출되는 단백질로 여러 뇌 질환의 중증도와 연관이 있는 것으로 밝혀졌다. 회사 측은 “유럽과 미국에 존재하는 여러 임상연구기관을 통해 임상을 진행할 예정이며, 혁신적인 바이오 마커를 활용해 NeuroSTAT의 효과를 평가, 입증하겠다”고 밝혔다. NeuroSTAT은 미국과 유럽에서 외상 후 뇌 손상에 대한 희귀의약품으로 지정된 바 있다.
한편, 영진약품이 2017년 뉴로바이브로 기술수출한 KL1333은 NAD+의 수준을 조절함으로써 미토콘드리아의 손상을 교정하는 후보물질로 현재 만성 미토콘드리아 호흡 체인 질환을 적응증으로 영국에서 임상1상을 승인받아 진행되고 있다.

▲뉴로바이브의 파이프라인(출처: 뉴로바이브 홈페이지)
◇ Khondrion: KH176
콘드리온(Khondrion)은 미토콘드리아 질환을 대상으로 하는 저분자화합물 치료제를 개발하는 기업으로 네덜란드에 기반을 두고 있다. 이들은 독자적인 세포 이미징 기술과 환자 유래 세포 은행, 세포 기반의 질환 예측 모델 등의 개발 엔진을 보유하고 이를 활용해 미토콘드리아 질환의 새로운 치료제와 비이오 마커를 발굴한다.
콘드리온의 선도물질 KH176은 희귀 유전질환 중 하나로 근병증(myopathy), 뇌병증(encephalopathy), 유산증(lactic acidosis), 뇌졸중 유사 증상(stroke-like episodes) 등이 발생하는 MELAS 스펙트럼 장애의 치료제로 개발하고 있다. MELAS 증후군은 미토콘드리아 DNA 가운데 주로 3242번 유전자에 변이가 생기면서 발생한다. 80%의 MELAS 증후군 환자가 해당 변이를 가진 것으로 알려졌다.
KH176은 경구형 저분자 화합물 신약 후보물질로 세포의 산화 및 환원과정에 작용하는 기전을 가진다. 환자 유래 섬유아세포를 이용한 전임상 세포실험에서 KH176은 세포의 산화-환원 조절을 보호하는 효과가 있음을 보여줬다. 또한 다양한 유전자 결핍 마우스 실험에서 뇌의 미세구조를 유지하고 신경절 세포의 퇴행을 억제했으며 대뇌 피질에서 관찰되는 지질 과산화(lipid peroxidation)을 개선하는 결과를 얻었다. 정상인을 대상으로 진행한 KH176의 임상1상에서 최대 800mg을 일 2회 투약했을 때에도 높은 안전성을 확인했다. 이러한 결과를 바탕으로 KH176은 EMA로부터 MELAS 증후군과 Leigh 질환에 대한 희귀의약품으로 인정받았다.
콘드리온은 미토콘드리아 3242 유전자의 아데노신이 구아닌으로 바뀐 유전자 변이를 가진 MELAS 스펙트럼 장애 환자 18명을 대상으로 임상2a상(KHENERGY PhII a)을 수행했다. 해당 임상은 단일 센터에서 무작위로 대조군과 KH167군을 선별한 뒤, 위약 대비 KH167의 내약성과 안전성, 약동학을 확인하기 위해 수행됐다. 이들은 4주간의 치료 이후 임상적 증상과 신호, 미토콘드리아 질환의 바이오마커를 평가했다.
임상 결과, 매일 2회 100mg의 KH167를 경구 복용했을 때에도 내약성이 뛰어나고 안전한 것으로 나타났다. 보행과 관련된 평가에서 유의한 개선은 관찰되지 않았으나 기분의 조절이나 주의력과 관련한 항목에서 긍정적인 변화가 보였다. 콘드리온은 이러한 결과가 미토콘드리아 환자에게서 우울 증상이 나타나는 유병률을 고려할 때 임상적 가치가 있다고 피력했다.
회사 측은 적정한 용량을 확정하기 위한 임상2b상(KHENERGYZE)을 설계하고, 이를 수행하기 위한 절차를 진행 중이다. 2019년 2분기 첫 환자 투약이 예상되고 있다.

▲콘드리온의 파이프라인.(출처: 콘드리온 홈페이지)









댓글목록 0